Astro13/Strahlung
Stundenprotokoll "Grundlagen der Spektroskopie"
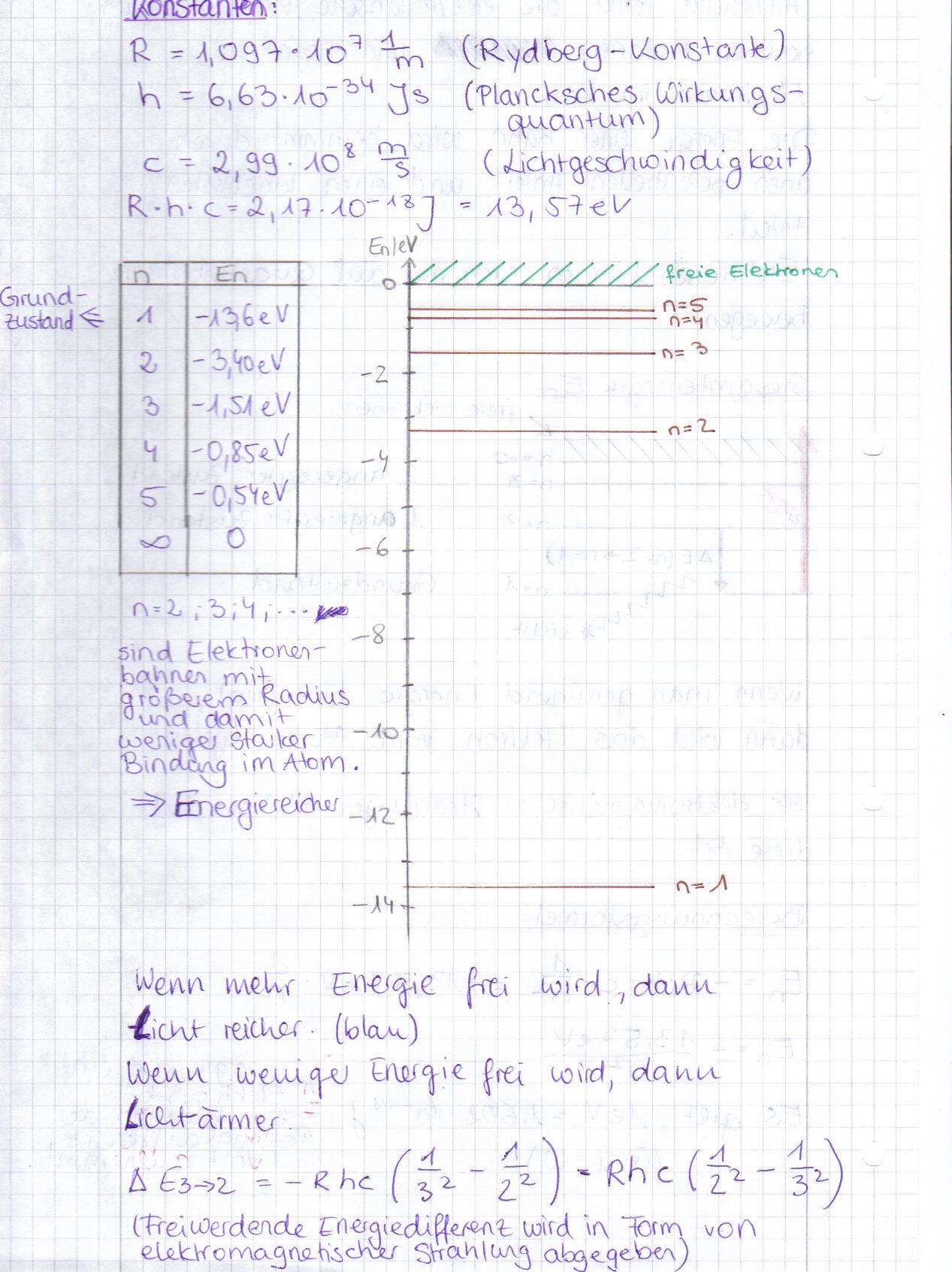
Energieniveaus
Wiederholung der Unterrichtsstunde vom 3. Februar 2010
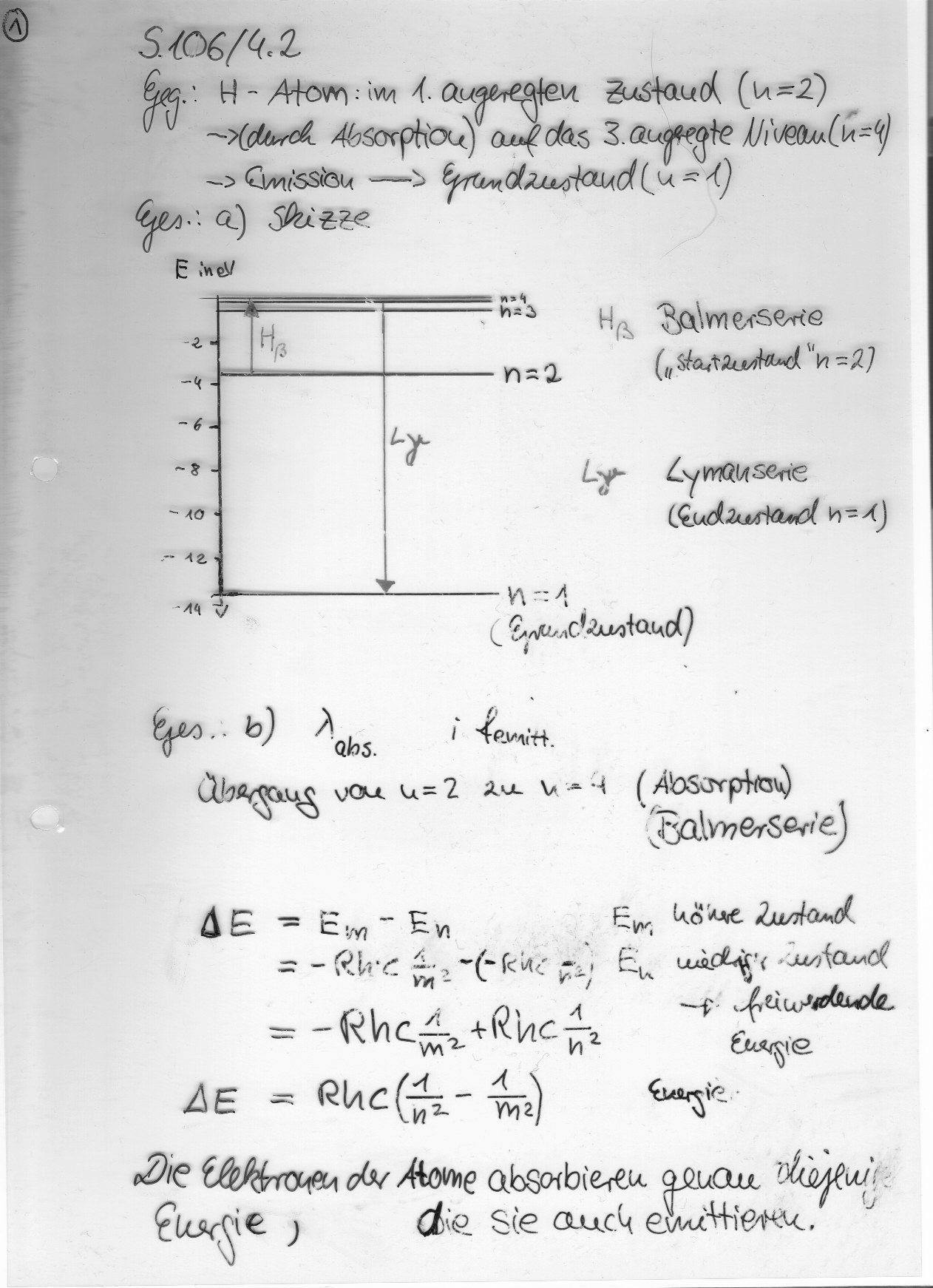
Wellenlänge der emittierten Strahlung
1 1
Formel zur Berechnung: 1/ λ= R • ( ─ - ─ )
n^2 m^2
n ist das niedrigere Niveau
m ist das höhere Niveau
Rechenbeispiel:
m=3 -> n= 2
1/λ= 1,097• 10^7 ½^2- 1/3^2) 1/m -> vom Ergebnis den Kehrwert nehmen
λ= 6,56•10^-7 m= 656 nm
Das Licht dieser Wellenlänge ist ein warmer Rotton, es ist für das menschliche Auge sichtbar.
( Nachweis durch Spektrallampe: roter Strich auf dem Wasserstoffgas)
Unsere Formel gilt nur für Berechnungen des H- Atoms, da bei höheren Elementen mehr Energieniveaus auftreten, bei Molekülen zusätzlich Energieniveaus für Rotationen und Schwingungen.
Beim H- Atom gibt es Spektralserien
Endzustand Name
n= 1 Lyman- Serie kürzere Wellenlänge (UV)
n= 2 Balmer- Serie z.B.: 3->2, 4->2, 5->2
n= 3 Paschen- Serie längere Wellenlänge (IR)
Anregungen entstehen z.B. Temperaturstöße. Je höher die Temperatur, umso mehr Energie wird aufgenommen, die wieder abgestrahlte Wellenlänge ist kürzer.
Anwendungsbeispiel:
Die Sonne emittiert Linien des Wasserstoffs und Helium. Sie besteht hauptsächlich daraus.
Die allermeisten Sterne tun das gleiche, sind also ähnlich der Sonne aufgebaut.
Strahlunsabsorption
Definition: Absorption bedeutet, dass Elektronen auf höhere Quantenbahnen springen.
E> 13,6 EV -> Elektronen werden aus dem Verbund „gekickt“ (Ionisierung)
Anwendungsbeispiele:
Erdatmosphäre: Moleküle in der Atmosphäre (Ozonschicht) absorbieren UV- Strahlung
-> OZONLOCH (Ozonhülle= Schutzschild ist beschädigt!!!!!)
Treibhausgas absorbiert Infrarotstrahlung.